(1) 粗蛋白 (crude protein):採樣 → 均質打破細胞 → 抽出全部蛋白,多用鹽析沉澱法。
(2) 部分純化 (partially purified)︰初步的純化,使用各種管柱層析法。
(3) 均質蛋白質 (homogeneous)︰目標蛋白質的進一步精製純化,可用製備式電泳或 HPLC 等。
資料來源:國立臺灣大學
二、分離方法(method)
蛋白質純化技術
| |
依大小
|
透析
超濾
膠體過濾
蔗糖梯度超高速離心
|
依溶解度
|
等電點聚焦法
鹽溶、鹽析
|
依帶電性
|
離子交換層析法
|
親和性純化
|
----
|
高效率層析法
|
----
|
A. 透析(Dialysis):
a. 將原溶液置於透析袋,再置於緩衝溶液中,小分子可通過透析袋進入緩衝液,透析袋內的小分子數目會減少,而大分子數目卻不變,重複多次之後就可以把小分子的數目降到很少。
b. 運用:脫鹽(Desalination)
C. 膠體過濾(Gel filtration):膠体過濾法是一種 Partition 層析法。小分子可進入小珠子(beads)的孔洞內,大分子不可進入,因此小分子經過的路徑較長,會停留較久,而大分子經過路徑短,會較快流過。簡單來說,就是利用時間差以達到分離純化的目的

資料來源:bricker
資料來源:bricker
D. 蔗糖梯度超高速離心(Surcose gradient centrifugation):依蛋白密度差異而分離,密度越大的蛋白質越接近管底,密度越小的越接近液面。流程:
a. 利用儀器製造蔗糖梯度
b. 在液面緩緩滴入樣品形成薄膜
c. 放入離心機高速離心
d. 最後分裝溶液
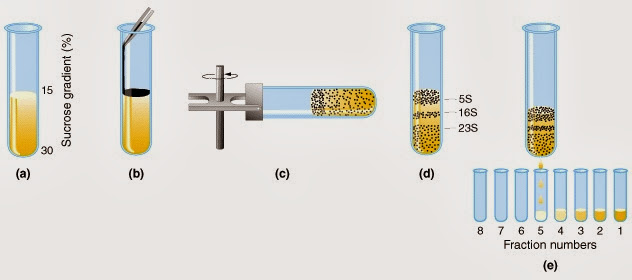

資料來源:lyricsdog
2. 利用蛋白質溶解度(Solubility)差異
A. 等電點聚焦法(Isoelectric focusing,IEF)
b. 蛋白在某pH值下電荷為0→此pH質=等電點(pI)
c. 將蛋白質置於具有pH梯度的膠體進行電泳,它會朝著與自身所帶電性相反的電極方向移動,直到抵達pI處才停止運動。此過程蛋白被「聚焦」在等電點的窄帶中
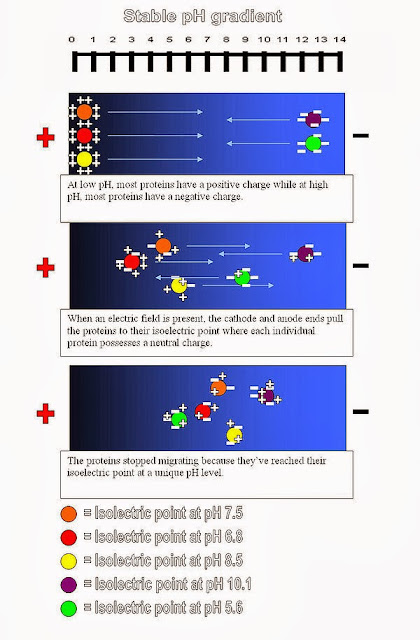
資料來源:維基教科書

資料來源:維基教科書
B. 鹽溶、鹽析(Salting in & Salting out)
@鹽溶 Salting-in:加鹽使蛋白質溶入水溶液中
@鹽析 Salting-out:加鹽使蛋白質由水溶液中沉澱出來
@鹽溶 Salting-in:加鹽使蛋白質溶入水溶液中
@鹽析 Salting-out:加鹽使蛋白質由水溶液中沉澱出來
鹽溶(Salting in)
|
鹽析(Salting out)
| |
原理
|
分子在其等電點時,容易互相吸引,聚合沉澱;加入鹽離子會破壞此吸引力,使分子散開,溶入水中
|
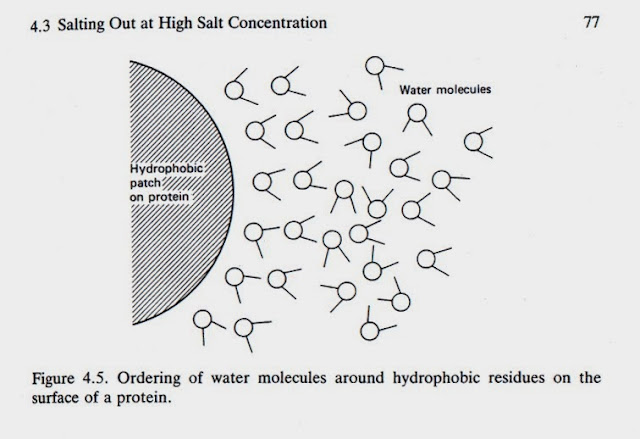
蛋白質表面的疏水性區域,都聚集許多水分子,當鹽加入時,這些水分子被抽出,以便與鹽離子進行水合,此時暴露出疏水性區域和親水性區域相互結合,形成沉澱
|
使用鹽離子
|
氯化鈉NaCl
|
硫酸銨(NH4)2SO4
|
濃度
|
150mM≒0.9%(較低)
|
40%~70%(較高)
|

鹽析(Salting out)圖
鹽溶(Salting in)&鹽析(Salting out)比較
資料來源:linjah
3. 離子交換層析法(Charge ion exchange chromatography):此方法運用蛋白質的pI 與環境pH 之間的相關性
4. 親和性純化(Affinity purification)
A. 當欲純化蛋白會與一配體(ligand)結合,即可使用此配體來純化目標蛋白
B. 例如:欲純化穀胱甘肽S轉移酶(Glutathione S-transferase),將Glutathione固定在beads上,當蛋白溶液通過時,酵素就會結合在beads上,而其餘不相干的蛋白則會流掉
C. 此方法也可以用來純化抗體,抗體可以和抗原結合,將抗原固定在beads上,當抗體流經過後,就會與抗原結合
5. 高效率液體層析法(HPLC High-performance liquid chromatography):為一高解析度的分離方法
,須使用一金屬管柱,緊密充填許多小直徑的小珠子,此時將蛋白溶液推進入管柱內。推入過程會產生極大的回壓,故須使用一高壓的幫浦,若使用玻璃或塑膠管柱則易破掉


整理得太棒了!
回覆刪除