現時已知的組織蛋白並有六種,分別為H1(有時稱為連接組織蛋白H5)、H2A、H2B、H3、H4及古細菌組織蛋白。
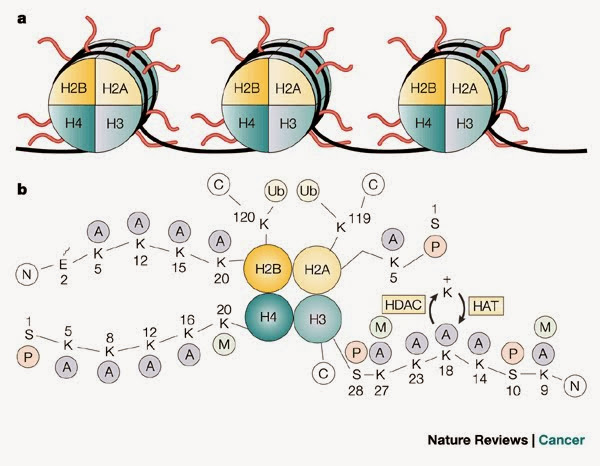
在H2A、H2B、H3及H4這四種組織蛋白中的其中兩種稱為「核心組織蛋白」,並且集合成為八聚體的核小體核心顆粒。這種集合是將DNA的146對鹼基對以1.65左手超螺旋形圍在這個蛋白質線軸。連接組織蛋白H1將核小體核心顆粒與DNA的進入位點及E位點結合,因而可以將DNA緊扣在位,並且能容許形成更高層次的結構。最基本的形狀為一個10奈米的纖維或一連串的珠子。這涉及將在每一個核小體之間約50對的DNA鹼基對圍在這些核小體上,這些DNA又稱為連接DNA。較高層次的結構包括有30及100奈米的纖維,是在一般細胞內的結構。在減數分裂中,透過核小體與其他蛋白質的相互作用,合成染色體。合成的組織蛋白與DNA稱為染色質。
核心組織蛋白是高度保守的蛋白質,意即組織蛋白在胺基酸序列中有著非常小的改變。連接組織蛋白通常有著多於一種的形狀,對比核心組織蛋白是保守程度較低的。
在主要的組織蛋白類別中,亦存在一些異構體。它們有著相同的胺基酸序列及相似的核心結構,但卻有著不同的特徵。這些不同的組織蛋白通常帶著染色質的特別功能,就如與H3相似的CenpA是唯一的組織蛋白與染色體的著絲點聯合;H2A的異構體H2A.Z是與活性轉錄基因聯合與涉及在異染色體的形成;另一個H2A異構體H2A.X以雙鏈斷裂與DNA結合,並進行DNA修復。
H1
組織蛋白H1有著一個中央球狀結構域及長的C與N端尾巴,能將小珠子串結構圍成30奈米大小的螺線管結構。對比其他種類的組織蛋白,H1的數量只為其他的一半。這是因為它不是構成核小體部份,而只是將DNA及核小體緊扣在一起。H1亦有著它的異構體,稱為組織蛋白H5。
H2A、H2B及H4
組織蛋白H2A、H2B及H4同樣有著一個主要的球狀結構域與長的N端尾巴,是組成小珠子串結構內的核小體的重要原素。
H3
與組織蛋白H2A及H2B類似,組織蛋白H3有著一個主要的球狀結構域與長的N端尾巴,是組成小珠子串結構內的核小體的重要原素。它的N端尾巴從球狀核小體核心伸出,能進行多種影響細胞運作的表觀遺傳修飾。這些修飾包括將甲基及乙醘基共價附著於離胺酸或精胺酸,及絲胺酸或羥丁胺酸的磷酸化。離胺酸9的甲基化涉及基因沉默及在DNA內形成相對較不活躍的異染色質。組織蛋白H3的乙醘基化會在組織蛋白尾巴內不同的離胺酸位置出現,並且由組織蛋白乙醘轉移酶(HAT)所催化。離胺酸14的乙醘基化在基因中很普遍,亦會轉錄成為核糖核酸(RNA)。
資料來源:維基百科
組織蛋白多由精胺酸(Arginine)與離胺酸(lysine)的殘基所構成
資料來源:自然期刊

資料來源:維基百科

資料來源:fastbleep
一、組織蛋白功能
1.穩定DNA結構:組織蛋白(histone protein)屬酸性,帶正電,當它們與DNA(含磷酸根,帶負電))結合,可以形成穩定結構
2.促使DNA的纏繞(Coiling) :DNA捆綁組織蛋白(histone protein),組織蛋白(histone protein)經纏繞使染色絲的半徑由2nm增加到30nm
3.為一種保守性的蛋白質,不同生物間,組織蛋白相似性很高,如牛與碗豆的H4蛋白序列很類似,二者僅相差一個胺基酸
▼胺基酸(amino acid)相關
顯示/隱藏(show/hide)
▼遺傳物質(genetic material)
顯示/隱藏(show/hide)
請問病毒有 histone 嗎
回覆刪除没有额
刪除組蛋白是鹼性喔
回覆刪除為何真細菌沒有組織蛋白?
回覆刪除